لحظات الاكتشاف الحقيقية على غرار تلك التي قال فيها أرخميدس: ’وجدتُها‘ نادرة في العلم، لكن ذلك حدث قبل عَقد من الزمن عندما تحول البحث في وظيفة غريبة لعلم المناعة البكتيرية إلى اكتشاف كوفئ لاحقاً بجائزة نوبل. الورقة البحثية التي نشرتها في العام 2012 جينيفر دودنا Jennifer Doudna وإيمانويل شاربنتييه Emmanuelle Charpentier معترف بها على أنها علامة فارقة في مجال العلوم.
كان الباحثون يعملون منذ ثمانينات القرن العشرين على جمع معلومات حول كريسبر CRISPR وهو اختصار لعبارة التكرارات العنقودية المتناظرة القصيرة منتظمة التباعدClustered Regularly Interspaced Short Palindromic Repeats. وهي تمثل في الطبيعة آلية دفاع جزيئية تستخدمها البكتيريا لاكتشاف وتدمير الحمض النووي DNA للفيروس الغازي، وتعمل مثل مقصات مجهرية. عندما تصاب بكتيريا بالعدوى، يضطلع ’المقص‘ بقطع ولصق جزء من الحمض النووي DNA للفيروس وإدخاله في الجينوم الخاص بها. هذا يدرِّب النظام على التعرف على ذاك الحمض النووي DNA وتدميره.
حدث الإنجاز العلمي الخارق عندما عزل العلماء إنزيمات معينة والحمض RNA (حمض الريبوزي Ribonucleic acid) الذي يُصنع منه المقص الجيني. إعادة إنتاجه في المختبر هي ما حول كريسبر إلى أداة كان من شأنها تسريع خطى البحث البيولوجي. كانت طريقة بسيطة لتعديل أو تحرير جينومات أي كائن حي.
«الحقيقة أنه بعد 10 سنوات فقط من اكتشافها، تعمل تقنية كريسبر على إنقاذ حياة الناس»
كيف تؤثر هذه التكنولوجيا في الطب؟
يحدث عدد من الاضطرابات الوراثية بسبب طفرة في جين واحد. تسمح قوة (ودقة) كريسبر للعلماء بإزالة هذه الطفرات من الجينوم البشري من خلال تدخل علاجي واحد يغير الحياة. كانت علاجات كريسبر لاضطرابات الدم، مثل مرض فقر الدم المنجلي وثلاسيميا بيتا، من بين أولى العلاجات التي بلغت مستوى التجارب على البشر، وكانت النتائج المبكرة مشجعة. وحالياً بفضل تقنية كريسبر يتعافى مرضى من أمراض قاتلة سببت آلاماً مزمنة وتطلبت علاجاً منتظماً. الحقيقة هي أنه بعد 10 سنوات فقط من اكتشافها، تعمل تقنية كريسبر على إنقاذ حياة الناس. وقد تصدرت أخبار استخدام علاجات كريسبر الأولى لاضطرابات الدم في العام 2023.
عملياً أي مرض سببه مكون وراثي يحتمل أن يوجد له علاج بتقنية كريسبر. التجارب جارية لحالات متنوعة مثل العمى والسرطان والسكري وفيروس نقص المناعة البشرية/الإيدز. يمكن أيضاً استهداف أمراض مثل أمراض القلب والخرف، لأن الباحثين لا يدرسون الجينات المسببة للمرض فحسب؛ بل يبحثون أيضاً عن طرق لإدخال الحمض النووي DNA الواقي في الجينوم البشري.
ماذا عن اللقاحات؟
توصف أداة CRISPR-Cas9 أحياناً بأنها ملصق يحمل كلمة ’مطلوب’ معلق في الجهاز المناعي للكائن الحي. من هنا تشبيهها بأنها فيروس يمكنه تعليم الجهاز المناعي كيف يتعرف على الغازي المحتمل.
صُممت لقاحات بمختلف الأنواع لأداء المهمة نفسها: تنبيه جهاز المناعة مسبقاً حول الغزاة المحتملين. بفضل دقتها وسهولة استخدامها، يمكن أن تساعدنا تقنية كريسبر على صنع أنواع جديدة من اللقاحات. في أثناء جائحة كوفيد-19 استُخدمت كريسبر لتطوير بعض لقاحات الحمض النووي الريبي المرسال mRNA، وتُستخدَم حالياً لتسريع إعداد لقاحات جديدة، بما في ذلك لقاح ضد الملاريا. من خلال العمل مع طفيلي (المتصورة المنجلية) بلازموديوم فالسيباروم Plasmodium falciparum الذي يسبب الملاريا، حذف علماء في واشنطن ثلاثة جينات ضرورية للطفيلي لإصابة البشر. بعد تعرضهم للسعة بعوض يحمل طفيلياً معدّلاً بتقنية كريسبر، حصل الأشخاص على الحماية من الملاريا عدة أسابيع، وذلك بفضل الأجسام المضادة التي ينتجها الجسم.
كيف تعمل تقنية كريسبر على تغيير الأغذية والزراعة؟
هل يرغب أي شخص في الطماطم الحارة؟ ماذا عن بعض المكسرات التي لا تسبب الحساسية؟ أو برغر من ثلاث طبقات يمكن الاستمتاع به من دون رفع مستوى الكولسترول؟ هذه بعض الاحتمالات اللذيذة على القائمة فيما بدأ الباحثون في استخدام تقنية كريسبر لإنتاج أطعمة ذات سمات غير عادية.
في الزراعة تُستخدَم كريسبر لإنتاج محاصيل مقاومة للآفات أو الجفاف. مع تزايد الطلب على الغذاء، يتطلع الباحثون إلى إنتاج محاصيل ذات إنتاجية أعلى عن طريق طمس الجينات التي تقيد النمو.
تتسابق شركات التكنولوجيا الحيوية لتطوير الأطعمة التي تجعلنا نتمتع بصحة أفضل أو يمكن تناولها بأمان، ويضطلع باحثون بتطوير المكسرات والقمح والأطعمة الأخرى التي يجري تحريرها لإزالة المواد المسببة للحساسية فيها. الطماطم التي أمكن تعديلها بتقنية كريسبر معروضة للبيع بالفعل في اليابان.
تُستخدم تقنية كريسبر أيضاً لتطوير اللحوم المزروعة في المختبر، وتظهر الأبحاث أن تقنية كريسبر تقلل كوليسترول البروتين الدهني منخفض الكثافة (LDL) في النسانيس بنسبة 70% في غضون أسبوعين.
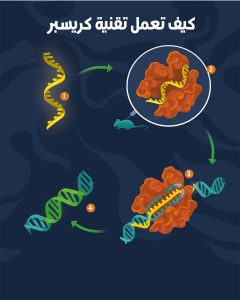
1 . يُنشَأ خيطٌ من جزيء الحمض النووي الريبي RNA ’المرشد‘ مطابق لتسلسل الحمض النووي DNA للهدف المقصود.
2 . يُدمج Cas9 – ’المقص الجزيئي‘ – مع الحمض RNA ويُحقَنان في النبات أو الحيوان أو الإنسان الذي يتلقى العلاج.
3 . ثم يوجِّه الحمض النووي الريبي RNA الإنزيم Cas9 إلى المكان المحدد على الحمض النووي DNA حيث يلزم التعديل. هنا يضطلع Cas9 بقص جزء من خيوط الحمض النووي DNA، وإزالة المادة الجينية غير المرغوب فيها.
4 . يدخل العلماء الحمض النووي DNA الصحي في الجينوم ليحل محل الجزء المقطوع.
«من خلال تعديل جينوم النوع الحي في الأماكن التي يختلف كل منهما عن الآخر فيها، يعتقد الباحثون أن في إمكانهم إعادة حيوانات انقرضت، أو إنشاء هجين يشترك في بعض الحمض النووي DNA»
هل يمكن أن تعيد تقنية ’كريسبر‘ المخلوقات المنقرضة؟
لدى كريسبر القدرة على أخذ الحمض النووي DNA الباقي من نوع منقرض ومقارنته بجينوم كائن حي على صلة به. من خلال تعديل جينوم النوع الحي في الأماكن التي يختلف كل منهما عن الآخر فيها، يعتقد الباحثون أن في إمكانهم إعادة حيوانات انقرضت، أو إنشاء هجين يشترك في بعض الحمض النووي DNA.
المثال الأكثر شهرة هو الماموث الصوفي الذي مات قبل نحو 10,000 عام، والعلماء ليسوا متأكدين مما إذا كان البشر قد دفعوه إلى حافة الهاوية، أو إنه واجه صعوبة للبقاء على قيد الحياة في درجات حرارة الأرض المرتفعة. في كلتا الحالتين، قد لا نعرف على وجه اليقين ما جرى له. عُثر على عدد من العينات المحفوظة مدفونة في الجليد ولم يستخرج العلماء الحمض النووي DNA للماموث فحسب، بل تمكنوا أيضاً من سَلْسَلة الجينوم بكامله.
حالياً يحاول الباحثون إعادة الماموث إلى غابات التندرا في القطب الشمالي. وتستخدم شركة Start-up Colossal تقنية كريسبر لتعديل جينومات أفيال آسيوية لمنحها سمات تتيح لها التكيف مع البرودة مثل أبناء عمومتها المنقرضة منذ زمن بعيد، مثل الأذنين الأصغر حجماً وزيادة الدهون في الجسم. وتعتقد الشركة أن العجول الأولى ستولَد في غضون خمس سنوات.
كما يجري تنفيذ مشروعات لإحياء حيوانات انقرضت أخيراً، مثل النمور التسمانية والحمام المهاجر.

توصف كريسبر أحياناً بأنها ’سهلة’. قد لا يكون الأمر متعلقاً بعلم شديد التعقيد، ولكن تحرير الجينوم ما زال عملية معقدة ومكلفة جداً، خاصة عندما يتعلق الأمر بعلاج الأمراض. يعمل باحثون على تحسين آليات توصيل كريسبر عبر البحث عن إنزيمات قد تكون أكثر فعالية من Cas9 ومحاولة الحد مما يُعرف باسم ’التأثيرات غير المستهدفة‘ Off-target effects. تحدث هذه عندما لا تؤثر عملية التحرير في الحمض النووي DNA المستهدف فحسب، بل تؤثر أيضاً في جينات أخرى داخل الكائن الحي.
كما قد لا تكون أكبر التحديات تقنية، بل أخلاقية. فقد وُصم التحرير الجيني منذ البدء بأنه محاولة للمسِّ بما لا ينبغي المساس به في الكائنات الحية. ويطرح الباحثون أنفسهم أسئلة حول التكنولوجيا واستخداماتها. هل ستؤدي إلى مزيد من عدم المساواة الصحية مع حصول الأغنياء حصرياً على العلاج؟ هل يجب استهداف خط الخلايا الإنتاشية (الخلايا الجنسية) Germline cells، بما أن أي تعديلات تُجرى يمكن أن تمر إلى الجيل اللاحق؟ وفيما يصير الوصول إليها أكثر سهولة، كيف يمكن تنظيم التكنولوجيا لجعلها في خدمة أغراض الرعاية الصحية البشرية وليس التحسين البشري؟

في العام 2018، وُلدت فتاتان توأمان في الصين وصارتا تُعرفان باسم ’طفلتَي كريسبر‘ CRISPR babies وهما أول طفلين خضعا لتعديل الجينوم في العالم. هندس عالم الفيزياء الحيوية هي جيانكوي He Jiankui طفرات في أجنة بشرية أمكن زرعها لاحقاً في رحم امرأة. وقال إنه عطل جيناً معيناً لمنح الأجنة الحماية من فيروس نقص المناعة البشرية.
وقد سُجن في الصين وأدانه المجتمع العلمي لتجاوزه خطاً أخلاقياً عن طريق تعديله خلايا سلالية بشرية – إذ إن الطفرات التي نقلها يمكن أن تنتقل إلى أطفال الفتاتين في المستقبل. كما أدين العالم لأنه لم يتبع إجراءات السلامة والأخلاق المنصوص عليها وغذى فكرة إنجاب أطفال ’مصمَّمين‘ بحسب الطلب، وهي الفكرة القائلة بأن تعديل الجينات سيسمح للآباء في المستقبل باختيار كل شيء، من لون عيون أطفالهم إلى ذكائهم.
«يحذِّر علماء الأخلاقيات من أنه في غياب التنظيم الدقيق، يمكن أن يؤدي تحرير الجينوم إلى مجتمع بمستويين»
يحذر علماء الأخلاقيات من أنه في غياب التنظيم الدقيق، يمكن أن يؤدي تحرير الجينوم إلى مجتمع بمستويين، منقسم بين أولئك الذين جرى تحريرهم وأولئك الذين لم يخضعوا لتلك التقنية.
ثورة جينية
1987
الحديث عن آلية كريسبر لأول مرة في الأدبيات العلمية.
2000-2002
العثور على مزيد من التكرارات العنقودية للحمض النووي في البكتيريا والعتائق Archaea. وصياغة مصطلح Cas9 (جاء Cas من البروتينات المرتبطة بكريسبر CRISPR-associated proteins).
2005-2008
نبدأ في تعلم كيف تحمي كريسبر وCas9 البكتيريا من الفيروسات.
2012
نشرت جينيفر دودنا وإيمانويل شاربنتييه وزملاؤهما بحثهم الذي مثل إنجازاً تاريخياً عن CRISPR-Cas9 كأداة لتحرير الجينوم.
2016
استخدم العلاج القائم على تقنية كريسبر لأول مرة في علاج إنسان، وهو مريض مصاب بسرطان الرئة.
2018
عالم الفيزياء الحيوية هي جيانكوي يعلن ولادة من عُرفتا باسم طفلتَي كريسبر، وهما فتاتان وُلدتا من أجنة معدلة جينياً.
2020
شاربنتييه ودودنا تحصلان على جائزة نوبل في الكيمياء لعملهما على تقنية كريسبر.
2021
إدارة الغذاء والدواء الأمريكية توافق على أول علاج بتقنية كريسبر لمرض فقر الدم المنجلي.
إيان تايلور Ian Taylor
إيان كاتب مستقل في العلوم والصحة، ومحرر سابق في BBC Science Focus

الطعام
يؤثر تغيُّر المناخ بالفعل على غلة المحاصيل. لا يستسيغ الجميع الأطعمة المعدلة وراثياً، لكن العلماء يستخدمون تقنية كريسبر لتطوير محاصيل مقاومة للجفاف والحرارة والفيضانات.
الوقود الحيوي
يمكن أن يؤدي الوقود الحيوي المعدل جينياً دوراً رئيساً في توفير الطاقة النظيفة. وبفضل تقنية كريسبر صار من الممكن زيادة إنتاج كمية وقود الديزل الحيوي من الطحالب الضوئية Phototropic algae مرتين.
النباتات
يستخدم علماء من كاليفورنيا تقنية كريسبر لإنبات نباتات تزيل ثاني أكسيد الكربون من الغلاف الجوي، وذلك بفضل البناء (التمثيل) الضوئي Photosynthesis المحسن والجذور التي تودِع الكربون في عمق التربة.
الميكروبات
تحدثت جينيفر دودنا، التي ساهمت في اكتشاف كريسبر، عن إمكانية استخلاص مزيد من الكربون من الغلاف الجوي بفضل التربة والميكروبات المعدلة بتقنية كريسبر.
الشعاب المَرجانية
يستخدم علماء أمريكيون تقنية كريسبر لدراسة الجينات الموجودة في المرجان التي تؤثر في تحمل الحرارة. يأملون أن يساعد ذلك جهود الحفظ إذ تتأثر الشعاب المرجانية بارتفاع درجات حرارة البحر وتحمُّض المحيطات.
الميثان
يشكل الميثان المنبعث في أثناء إنتاج الأرز 2% من انبعاثات الاحتباس الحراري العالمية. تُستخدم تقنية كريسبر في إنتاج محاصيل وماشية تطلق كميات أقل من غاز الميثان.