تعرَّف على قتلة البكتيريا
بينما يكافح الأطباء لعلاج العدوى المقاومة للمضادات الحيوية، هل يمكن للعلماء أن يطوِّعوا مجموعة من الفيروسات التي تفّجر الخلايا البكتيرية من الداخل؟
توم أيْرلاند Tom Ireland
في عام 2021 سنبدأ بتسلم نتائج التجارب على طريقة جديدة ومثيرة للاهتمام لعلاج العدوى الخطيرة المقاومة للأدوية. وتتضمن هذه العلاجات حقن المرضى ببلايين من الجسيمات الفيروسية Virus particles التي تستهدف هذه البكتيريا على وجه التحديد وتقتلها.
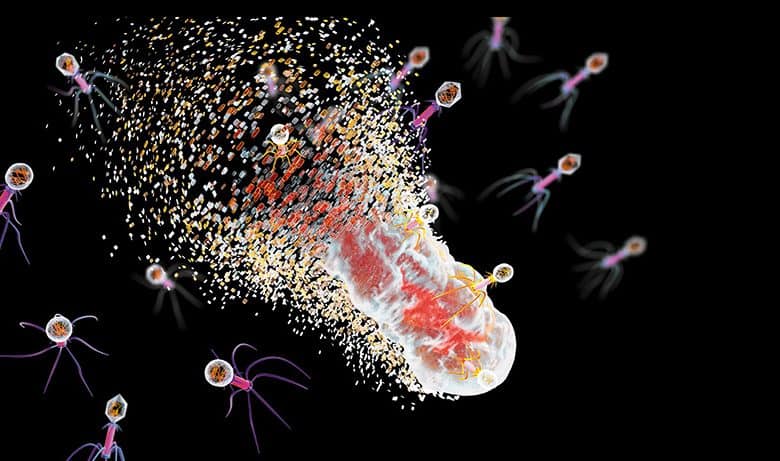
توجد مثل هذه الفيروسات، المعروفة بالبكتيريوفاج (البكتيريوفاجات) Bacteriophages (أو حتى “الفاجات” Phages فقط)، في كل مكان توجد فيه البكتيريا وتتكاثر عن طريق إدخال جيناتها في الخلايا البكتيرية. وبمجرد إصابتها بجينات الفيروس، يستبد الجنون بالخلية البكتيرية وتبدأ بإنتاج بروتينات فيروسية تتجمع لتكوِّن فيروسات جديدة. ففي غضون نصف ساعة، ليس إلا، تنفجر الخلية وتنطلق منها عشرات أو مئات من الفيروسات الجديدة لتكرار الدورة في مضيف آخر. إنها فعالة بشكل ملحوظ في فعل هذا: تشير بعض الدراسات إلى أنه مقابل كل حبة رمل على الأرض يمكن أن نجد أكثر من تريليون من البكتيريوفاج في أي وقت.
ونظراً لقدراتها الطبيعية على قتل البكتيريا، يمكن أن تمثل هذه الجسيمات المفترسة ذات الحجم النانوي المفتاحَ لمكافحة مشكلة مقاومة مضادات الميكروبات المتزايدة. وفكرة استخدامها في الطب ليست جديدة على الإطلاق.
قبل أكثر من 100 عام، في عام 1919، دخل عالم غريب الأطوار يُدعى فيليكس ديرال Félix d’Hérelle مستشفى للأطفال في باريس وأخبر الأطباء بأنه وجد طريقة لعلاج الزحار (التهاب في الأمعاء) Dysentery. فقد حدث هذا قبل عقود من توفر المضادات الحيوية مثل البنسلين، عندما كانت العدوى البكتيرية الشائعة تقتل الملايين سنوياً.
وأثناء دراسة مستعمرات البكتيريا لاحظ ديرال انتشار مرض ما في أطباق البكتيريا Bacterial plates في المختبر. وعلى الرغم من أنه لم يكن يُعرف شيء تقريباً عن الفيروسات في ذلك الوقت، فقد توصل ديرال على نحو استثنائي إلى الاستنتاج بأنه اكتشف فيروساً يفترس البكتيريا، وليس البشر – وهو ميكروب يصيب ميكروباً آخر. وأطلق ديرال على الفيروس اسم البكتيريوفاج (“آكلة البكتيريا”) وبدأ باستخدامه لمحاربة الالتهابات البكتيرية في الحيوانات.
كان هذا قبل وقت طويل من وجود هيئات تنظم تداول الأدوية مثل إدارة الأدوية الفيدرالية (FDA) في الولايات المتحدة أو هيئة تنظيم الأدوية ومنتجات الرعاية الصحية (MHRA) في المملكة المتحدة، وهي هيئات تختبر بدقة الأدوية والعلاجات الجديدة قبل الموافقة على استخدامها لدى المرضى. ولإثبات أن علاجه التجريبي آمن للاستخدام مع الأطفال المصابين بالزحار؛ فقد شرب ديرال ببساطة قنينة من البكتيريوفاجات أمام أطباء المستشفى. ووافق الأطباء على أن يجربوا العلاج في المستشفى إذا بقي ديرال على قيد الحياة في اليوم التالي.
وفي اليوم التالي كان ديرال بخير (لقد اختبر البكتيريوفاج بالفعل على نفسه وعلى أسرته). وعند وصول العديد من الأطفال المرضى الذين يعانون الزحار أُعطي كل منهم قارورة من فيروسات البكتيريا النقية ليشربوها. فقد كان العلاج ناجحاً. وتعافى الأطفال بسرعة وغادروا المستشفى في غضون أيام. وسرعان ما صارت البكتيريوفاج التي اكتشفها أحدث دواء عجيب متوفر حينها. وبحلول ثلاثينات القرن العشرين شُحنت حول العالم لعلاج معظم أنواع العدوى البكتيرية.
العلاج المنسي
إذن، كيف يمكن في عام 2020 أن نفسر أن عدداً قليلاً فقط من الناس سمعوا عن العلاج بالبكتيريوفاج؟ ولماذا، والعالم بحاجة ماسة إلى مضادات حيوية جديدة، لم تُستخدم في المستشفيات كل هذا الوقت؟ إنها قصة طويلة، ولكن بحلول خمسينات القرن العشرين، كان العالم الغربي قد نسي كل شيء تقريباً عن البكتيريوفاج. فقد ظهرت أدوية مثل البنسلين في السوق، وكانت أرخص بكثير وإنتاجها أسهل من الفيروسات الحية. ففي معظم أنحاء العالم ركزت الأبحاث الطبية على تطوير فئات جديدة من المضادات الحيوية وجرى التخلي تدريجياً عن فكرة استخدام الفيروسات لعلاج العدوى.
الدول الوحيدة التي استمرت باستخدام البكتيريوفاجات لعلاج العدوى هي البلدان السوفييتية، إذ كانت تعاني نقصا في الأدوية مثل البنسلين. ولكن الحرب الباردة حالت دون أي اتصال بين العلماء السوفييت وسائر العالم، لهذا لم يلاحظ أحد التحسينات التي أدخلوها على استخدام البكتيريوفاجات في العلاج. وبحلول ثمانينات القرن العشرين كان الطب الغربي قد نسي بالكامل تقريباً أن العلاج بالبكتيريوفاجات موجود في الأصل.
حالياً، ونظراً لأن البكتيريا المقاومة للأدوية تمثل مشكلة تزداد صعوبة في المستشفيات حول العالم، فقد أعيد طرح فكرة استخدام الفيروسات. يسافر المرضى اليائسون من الولايات المتحدة وأوروبا حالياً إلى “عيادات البكتيريوفاجات” Phage clinics في الدول السوفييتية السابقة، مثل جورجيا، بحثاً عن علاج لالتهابات لم يعد من الممكن علاجها بالمضادات الحيوية.
على الرغم من تجدد الاهتمام، لم يُستخدم العلاج بالبكتيريوفاجات خارج هذه المناطق بنجاح سوى في عدد قليل من الحالات التجريبية. ففي عام 2015 أصيب العالم توم باترسون Tom Patterson بمرض التهاب البنكرياس أثناء إجازته في مصر. وتبين أن السبب هو سلالة من البكتيريا المقاومة للأدوية. ومع عدم قدرة الأطباء على السيطرة على العدوى، سرعان ما دخل توم في غيبوبة. ولم يُشفَ بعد ما يقرب من عام من العلاجات التقليدية، ولكن كملاذ أخير، قررت زوجته ستيفاني ستراثدي Steffanie Strathdee، الباحثة في مجال فيروس نقص المناعة البشرية HIV، إجراء أبحاثها الخاصة وعثرت على فكرة استخدام البكتيريوفاجات لقتل البكتيريا التي كادت تقتل زوجها.
أمضت ستيفاني شهوراً وهي تحاول ربط أطباء توم بعلماء من معظم أنحاء العالم قد يكونون قادرين على الحصول على البكتيريوفاجات الصحيحة للسيطرة على العدوى (إضافة إلى ملء أكوام من الأوراق المطلوبة للحصول على الموافقة القانونية للعلاج – وهو ما يتعين على الأطباء فعله). وبفضل حقن مزيج تجريبي من البكتيريوفاجات، حصل الأطباء عليها من روسيا ومن البحرية الأمريكية ومياه الصرف الصحي غير المعالجة، فقد أُنقذ توم في النهاية بعد أن كان على حافة الموت.
وصفة حسب الطلب
استخدام البكتيريوفاجات ليس بالأمر السهل. فكل سلالة مختلفة من البكتيريا التي توجد منها الملايين، تقابلها سلالة معينة من البكتيريوفاجات التي تفترسها. لذلك يحتاج كل مريض إلى العلاج بالسلالة المناسبة تماماً من البكتيريوفاج لقتل البكتيريا المسببة للعدوى.
يزيل الجسم أيضاً البكتيريوفاجات من مجرى الدم بسرعة، ومثل المضادات الحيوية، يمكن للبكتيريا أن تطور وبسرعة مقاومة لها. هذا هو السبب الذي يتطلب استخدام مزيج من البكتيريوفاجات في كثير من الأحيان للتأكد من أنه في حال وجود بكتيريا مقاومة لبكتيريوفاج ما، فإن بكتيريوفاج أخرى ستقتلها.
يزيد هذا من تعقيد تطوير نظام علاجي. وينبغي أن نضع أيضاً في الاعتبار أن ما يصل إلى نصف جميع البكتيريوفاجات هي ما يُعرف بـ“البكتيريوفاجات المعتدلة” Temperate phages. إذ لا تفجر هذه الفيروسات دائماً الخلية البكتيرية وتقتلها. وبدلاً من ذلك، فإنها تفضل البقاء كامنة في جينوم الخلية أو التكاثر ببطء من دون قتل مضيفها. ويمكن للعلماء الالتفاف على هذا عن طريق تعديل البكتيريوفاجات جينياً وجعلها تستخدم استراتيجية “الانفجار” الأكثر عنفاً، بدلاً من الكمون والتستر.
في عام 2018، في مستشفى غريْت أورموند ستريت Great Ormond Street Hospital بلندن، استُخدم مزيج من ثلاث بكتيريوفاجات معدلة جينياً لعلاج مريضة شابة عانت انتشار عدوى مقاوِمة للأدوية في جميع أنحاء جسمها لسنوات. خضعت المريضة لعملية زرع رئتين بسبب التليف الحويصلي، وهي حالة تسبب تراكم المخاط في الرئتين. وبعد فترة وجيزة من العملية، وعلى الرغم من عدة جرعات من المضادات الحيوية، انتشرت الالتهابات من رئتيها إلى الكبد، وفي النهاية، كانت البكتيريا تندفع خارجة على شكل جيوب من خلال الجلد على ذراعيها وساقيها وأردافها.
هنا أيضاً، تطلب تطوير العلاج القائم على البكتيريوفاجات تعاوناً دولياً من الأطباء والباحثين في مجال البكتيريوفاجات لإيجاد البكتيريوفاجات الصحيحة التي تفترس سلالة معينة من البكتيريا لدى المريضة وتنقيتها وهندستها، ناهيك عن العوائق البيروقراطية الشاقة المطلوبة لإخضاع الفتاة لعلاج جديد وغير مرخص. ولكن المساعي أتت ثمارها، فقد نجح العلاج في السيطرة على العدوى وأنقذ حياة الفتاة.
مكتبات البكتيريوفاجات
قصص النجاح هذه ساعدت على تسريع الجهود المبذولة لتطوير العلاج بالبكتيريوفاجات في الولايات المتحدة وأوروبا، مع ورود أخبار جيدة مماثلة من العلاجات التجريبية والتجارب على الحيوانات في البلدان الأخرى. ولكن، على الرغم من هذه الأمثلة الإيجابية، فما زالت هناك عقبات كبيرة تحول دون أن تصير العلاجات بالبكتيريوفاجات مجدية من حيث التكلفة وموثوق بها لتُعتمد كعلاج في الممارسة الطبية.
تتمثل العقبة الرئيسية باحتمال إصابة كل مريض بمزيج فريد من السلالات البكتيرية، لذلك يجب أن يكون كل علاج متناسباً مع احتياجات كل مريض. وهذا يعني أن مصنعي الأدوية لا يمكنهم إنتاج جرعات كبيرة، كما أنه جعل من المستحيل على هيئات ترخيص الأدوية الموافقة على علاجات البكتيريوفاجات: إذ الأرجح أن تتطلب كل حالة مزيجاً مختلفاً تماماً من الفيروسات.
لحسن الحظ، تساعد الجهود التعاونية بين الباحثين وهيئات الصحة العامة والمنظمين على التغلب على هذه العقبات. والفكرة الحالية تقوم على أنه باستخدام تقنية تسلسل الحمض النووي DNA الحديثة، يمكن مسح مكتبات هائلة من البكتيريوفاجات Libraries of phages بسرعة للعثور على تطابق مناسب. ويمكن أيضاً فحص العينة المطابقة للتأكد من أنها لا تحتوي على أي جينات قد تُحدث تسمماً لدى المريض.
يمكن أن تقيِّم هيئات تنظيم استخدام الأدوية سلامة المكتبة ككل، وطرق تنقية البكتيريوفاجات وطريقة إعطائها للمريض، بدلاً من محاولة تقييم كل علاج فردي على حدة. وعندما يكون المريض مصاباً بعدوى مقاومة للأدوية، تُرسل معلومات دقيقة عن سلالة البكتيريا إلى مكتبة البكتيريوفاجات التي تُمسح ضوئياً بحثاً عن عينات مطابقة. وبعد ذلك يُرسل المزيج المطابق في أنبوب إلى المستشفى حيث يُعالج المريض. وبهذه الطريقة، يمكن إنتاج مزيج من الفيروسات المعدة حسب الطلب، والتي من شأنها إنقاذ حياة المريض في غضون أيام.
هذه هي الخطة على الأقل. وهناك العديد من التجارب الإكلينيكية الجارية والتي يؤمل أن تثبت، بشكل نهائي، أن البكتيريوفاجات قد تكون طريقة موثوق بها لعلاج العدوى، فيما تتواصل الجهود التعاونية بين السلطات والعلماء والأطباء على أمل وضع أنظمة مُنظِّمة يمكن أن تعطي الضوء الأخضر للعلاجات بالبكتيريوفاجات المفصلة حسب الطلب وبتكلفة معقولة.
نأمل بألا يواجه أي منا الاحتمال المرعب المتمثل بالإصابة بعدوى بكتيرية مقاومة للمضادات الحيوية التقليدية. ولكن إذا حدث ذلك، فمن المريح أن نعرف أنه يمكن الاستعانة بقاتلات البكتيريا القديمة هذه.